In questi giorni si è parlato molto del Favipiravir (meglio noto come: Avigan), un farmaco ad attività antivirale con presunta efficacia contro il SARS-CoV-2. Quello che fa maggiormente discutere, soprattutto i ricercatori, è però la notizia che l’Agenzia Italiana del Farmaco (AIFA) stia per dare “l’ok alla sperimentazione clinica” (1).
È davvero così? Proviamo a spiegarvi a che punto siamo.
Enti come AIFA, EMA (European Medicines Agency), FDA (Food and Drug Administration) e a livello globale l’OMS (Organizzazione Mondale della Sanità), stabiliscono i requisiti da soddisfare affinché un farmaco, o un vaccino, possano essere approvati e somministrati. Questo serve a garantire la sicurezza e l’efficacia del prodotto.
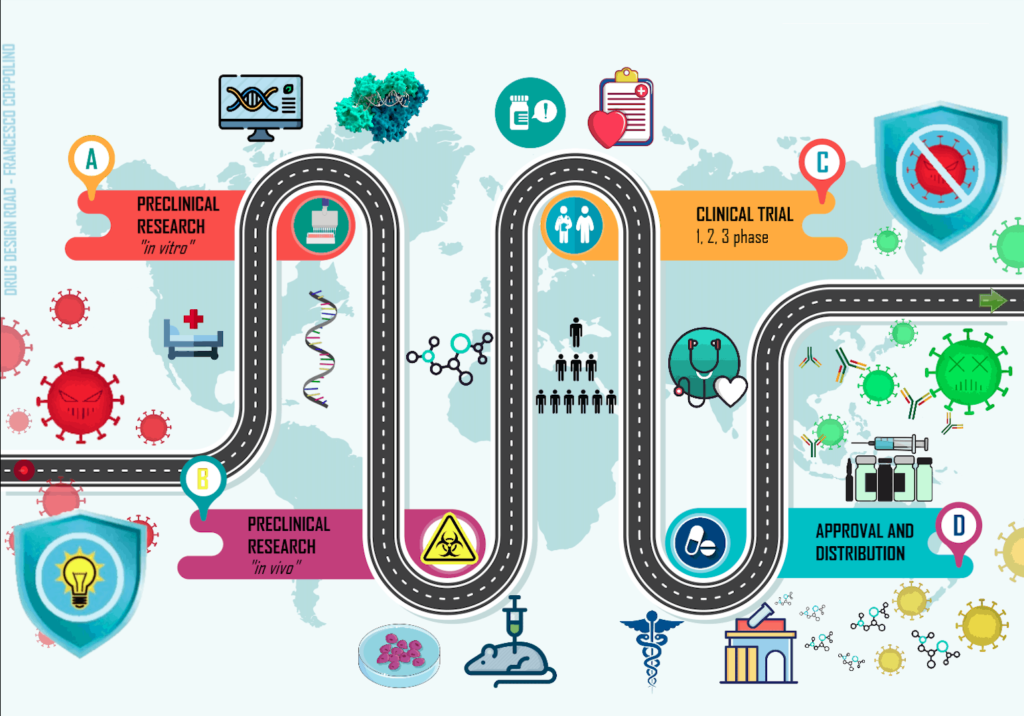
Proprio perché dimostrare la sicurezza e l’efficacia di un farmaco non è affatto banale, per ottenere la sua approvazione sono necessari numerosi studi e, anche, tempo. Per sintetizzare, bisogna che il prodotto superi con successo una fase pre-clinica (fatta di studi “in vitro” prima e “in vivo” poi, su modelli animali) e una fase clinica, in cui il farmaco viene testato finalmente sull’uomo (vedi immagine).
Questo iter richiede solitamente diversi anni e solo al termine del percorso il produttore può richiedere l’Autorizzazione all’Immissione in Commercio (AIC) per il farmaco.
L’attuale stato di emergenza (globale), autorizza l’attivazione di procedure di urgenza che consentono di snellire le attività burocratiche necessarie, ma NON autorizza però ad abbassare l’attenzione sulla sicurezza e l’efficacia del prodotto, perché si vogliono curare le persone e non mettere a rischio la loro salute inutilmente (qualcuno ricorda STAMINA? No: https://www.youtube.com/watch?v=91d9XB52Y80).
Quindi a che punto siamo con il Favipiravir:?
Le notizie diffuse nei giorni scorsi hanno creato molta confusione sullo stadio autorizzativo a cui si trova il Favipiravir. Andiamo quindi alla fonte e cerchiamo di fare chiarezza. Il Favipiravir, come dichiarato da AIFA in una nota pubblicata il 22 marzo (2), “È un antivirale autorizzato in Giappone dal marzo 2014 per il trattamento di forme di influenza causate da virus influenzali nuovi o riemergenti e il suo utilizzo è limitato ai casi in cui gli altri antivirali sono inefficaci. Il medicinale non è autorizzato né in Europa, né negli USA.”
L’Agenzia sottolinea inoltre “Ad oggi, non esistono studi clinici pubblicati relativi all’efficacia e alla sicurezza del farmaco nel trattamento della malattia da COVID-19”.
Il 23 marzo (3), l’AIFA ha precisato che “La Commissione Tecnico Scientifica, sulla base di preliminari e limitate evidenze di attività del medicinale favipiravir nella malattia COVID-19, è impegnata nella valutazione di un programma di sperimentazione clinica per valutare efficacia e sicurezza di questo trattamento.”
È stata quindi autorizzata la sperimentazione? No.
È stata bocciata? Nemmeno.
È attualmente in fase di valutazione, che vuol dire che l’Agenzia sta studiando i dati a disposizione per verificare la fattibilità della sperimentazione.
Inizierà? Solo se ci saranno dati sufficientemente robusti che indichino che non solo possa avere un ruolo nel curare la #Covid19, ma anche che nel farlo non faccia più male che bene. Se l’intervento riesce, ma il paziente muore è meglio, forse, non intervenire.
“???????? ?????????? ???????????? ?????? ??? ?????????? ?? ????? ??????????? – ?? ?? ????????? ????? ?????? ????? ?? ?????”
– ????? ?????
(1) https://tg24.sky.it/…/20…/03/23/coronavirus-avigan-aifa.html
https://www.ilmessaggero.it/…/coronavirus_avigan_sperimenta…
https://www.corriere.it/…/avigan-via-sperimentazione-17ada1…
(2) https://www.aifa.gov.it/…/favipiravir-aggiornamento-della-v…
(3) https://www.aifa.gov.it/-/aifa-precisa-uso-favipiravir-per-…
Approfondimento sulla ricerca clinica: http://www.prometeusmagazine.org/…/come-funziona-la-ricerc…/
Approfondimento sugli studi disponibili sull’Avigan:
https://cattiviscienziati.com/…/…/24/no-agli-youtube-trials/
Ringraziamo il socio Francesco Coppolino per il contributo.